OUTILS DE CARACTERISATION DES MATERIAUX FONCTIONNELS
Deux méthodes de préparation des verres de chalcogénures sont utilisée au laboratoire: (i) synthèse en tube silice sous vide dans un four et (ii) synthèse par broyage mécanique à température ambiante.
Pour la première technique de synthèse, les produits de départ sont purifiés et placés dans un tube en silice sous vide (Figure 1). Les tubes sont chauffés dans un four pour fondre et homogénéiser le mélange. Le Laboratoire possède 3 fours tubulaires type puits, un four basculant et deux fours électriques avec une température d’utilisation de 20 à 1200 °C (Figure 2). Puis une trempe à l’air ou dans l’eau froide est réalisée pour obtenir un verre (Figure 3).
 |  |
| Figure 1. Montage sous vide (approx. 10-6 mbar) utilisé pour la synthèse des verres de chalcogénures. | Figure 2. Fours utilisés pour la synthèse des verres de chalcogénures. |
 |  |
| Figure 3. Exemples des verres de chalcogénures obtenu par la méthode de trempe dans un tube en silice sous vide. | |
Une deuxième méthode de synthèse consiste à utiliser l’énergie mécanique au lieu de l’énergie thermique pour provoquer une réaction chimique. Pour cela, le broyage de la matière première est effectué dans un broyeur à billes (Figure 3) par des impacts de billes contre les parois de la cuve et entre les billes elles-mêmes pour obtenir une poudre micrométrique amorphe et homogène.
 |
| Figure 3. Planetary Micro Mill Pulverisette 7 premium line. |
La nature hygroscopique de certains verres et de produits de départ nécessite leur élaboration et leur caractérisation dans un environnement inerte. La boîte à gants (Figure 4) est utilisée pour éviter l’oxydation des verres lors de leur synthèse et caractérisation.
 | Caractéristiques :
|
| Figure 4. Boîte à gants “Plas-Labs Nitrogen Dry-Box Glove Box”. | |
L’étude du transport électrique dans les verres se fait en utilisant une combinaison de différentes techniques d’analyse (Figure 1) telles que la spectroscopie d’impédance complexe pour les verres ayant une conductivité élevée, les mesures de la résistivité pour les échantillons isolants (Figure 2) et la méthode Wagner ainsi que la méthode de diffusion par traceur radioactif effectuée à l’Université de St. Petersburg. Tout d’abord, la spectroscopie d’impédance complexe/résistivimètre nous permet d’avoir des informations sur les propriétés électriques des matériaux tels que la conductivité totale. Puis, nous pouvons employer la méthode Wagner qui nous permet de mesurer la conductivité électronique des matériaux. La diffusion par traceur radioactif est une technique expérimentale très performante pour étudier les phénomènes de transport ionique dans les solides. La combinaison entre ces trois techniques nous donne la possibilité de déterminer sans ambiguïté les contributions ioniques et électroniques de la conductivité.

Figure 1. Techniques d’analyse utilisées pour l’étude du transport électrique dans les verres.
 | RESISTIVIMETRE IMPEDANCE-METRE |
| Figure 2. Dispositif expérimental pour mesurer la conductivité des solides | |
Les propriétés thermiques des verres sont analysées à l’aide d’un calorimètre à balayage différentiel (DSC) Q200 TA Instruments (Figure 1). Deux systèmes de refroidissement sont disponibles :
- Le système de refroidissement à l’azote liquide (LNCS) offrant une fonction de refroidissement programmable de 550 à -180°C.
- Le système de refroidissement à air à ailettes (FACS, pour Finned Air Cooling System) qui utilise l’air ambiant pour refroidir la cellule DSC et permet de bénéficier de lignes de base stables et de vitesses de chauffage et de refroidissement linéaires entre la température ambiante et 725 °C.
 |
Figure 1. TA Instruments DSC Q200 differential scanning calorimeter |
Le Laboratoire possède une grande expérience dans la fabrication et la caractérisation des capteurs chimiques avec une membrane en verres de chalcogénures pour la détection de cations métalliques (Figure 1). La calibration des capteurs permet de définir la sensibilité, la limite de détection (Figure 2), les coefficients de sélectivité en présence d’ions interférents, la reproductibilité et l’influence de pH. Le dispositif expérimental pour la calibration des capteurs avec un assemblage des titreurs Mettler-Toledo est présenté sur la Figure 3.
 | 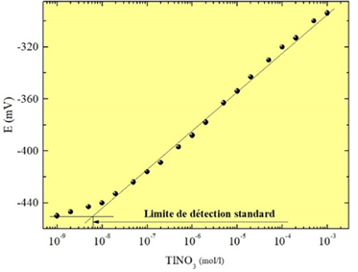 |
| Figure 1. Capteur chimique avec une membrane en verres de chalcogénures | Figure 2. Calibration de capteur sensible aux ions de thallium |
 |
| Figure 3. Dispositif expérimental avec les Titreurs Mettler-Toledo DL7x pour la calibration des capteurs chimiques. |


